
元素與化合物 (本區共瀏覽



 次)
次)
(一)金屬元素與非金屬元素的分類:
|
元素 |
定義 |
只含一種原子,不能以普通化學方法再分解的純物質。 |
||
|
命名 |
Fe 、O 2、O3 (臭氧)、C60(芙)都是元素。 |
|||
|
以印刷體大寫第一個字母大寫,第二個字母為小寫 |
||||
|
液態元素則為『水』部 |
||||
|
固態非金屬元素以『石』部為部首 |
||||
|
目前已知元素約115 種,分金屬與非金屬元素 |
||||
|
金屬元素與非金屬元素的性質比較 |
||||
|
物理性質 |
種類 |
金屬元素 |
非金屬元素 |
|
|
顏色 |
大部分為銀白色或銀灰色 銅為赤紅色,金為黃色。 |
沒有特定顏色 鹵素的顏色變化最大 |
||
|
金屬光澤 |
都有金屬光澤 |
沒有金屬光澤 |
||
|
延展性 |
有延展性,不易碎裂 金是延展性最大的金屬 |
都沒有延展性,易碎裂 |
||
|
導電及導熱 |
熱及電的良導體 導電性:銀>銅>金 傳熱性:銀>銅>鋁>鐵 |
熱及電的不良導體 石墨是唯一能導電的非金屬元素 |
||
|
密度、硬度 |
較大 |
較小(特別是氣體) 鑽石是自然界最硬的物質 |
||
|
熔點 |
較高 汞是熔點最低的金屬 鎢是熔點最高的金屬 |
較低 氦是沸點最低的元素 |
||
|
物態 |
常溫下多為固態 |
常溫下固態液態氣態皆有。 常溫下的液態非金屬:溴(Br) 氫氧氮氟氯為氣態元素 |
||
|
化學性質 |
活性 |
1. 活性大的金屬能與活潑的非金屬元素化合。 2. 鹼金族能與水作用產生氫氣。 |
3. 活性大的非金屬能與活潑的金屬元素化合。 4. 鹵族元素活性大。 |
|
|
氧化物 |
形成金屬氧化物。 |
形成非金屬氧化物。 |
||
|
水溶液 |
能溶於水者,呈鹼性。 不能溶於水者,呈中性。 |
能溶於水者,呈酸性。 不能溶於水者,呈中性。 |
||
【註】:物質溶於水,才能呈現出酸鹼性;若不能溶,則無法表現出酸鹼性。
(二)指示劑的顏色
|
種類 |
石蕊 |
酚酞 |
酚紅 |
廣用指示劑 |
紫色高麗菜 |
紅鳳菜 |
|
變色範圍 |
5.8~8.0 |
8.2~10.0 |
6.8~8.4 |
|
|
|
|
酸性 |
紅色 |
無色 |
黃色 |
紅橙黃 |
紅色 |
紅色 |
|
中性 |
不變色 |
不變色 |
不變色 |
綠色 |
不變色 |
不變色 |
|
鹼性 |
藍色 |
紅色 |
紅色 |
藍靛紫 |
綠色 |
藍綠色 |
(二)金屬元素與非金屬元素的命名
|
|
金屬元素 |
非金屬元素 |
|
固態 |
『金』部:金、銀、銅、鐵、錫、鋰、鈉 |
『石』部:碳、矽、硼、硫、磷、砷 |
|
液態 |
『水』部:汞 |
『氵』部:溴 |
|
氣態 |
無 |
『气』部:氫、氧、氮、氟、氯、溴、碘 |
(三)常見的金屬元素與非金屬元素:
|
種類 |
元素 |
重要性質 |
|
金屬元素 |
鐵 |
1. 為磁性物質,能製磁鐵。 2. 活性大,在潮濕的空氣中易氧化鏽蝕,氧化物質地疏鬆,會層層剝落。 3. 氧化鐵難溶於水,投入水中呈中性反應;易和酸反應,產生氫氣(H2)。 4. 依含碳量區分: 甲、生鐵-質硬而脆,適合鑄造,又稱為鑄鐵。 乙、熟鐵-富延展性,適合燬燒,又稱為煅鐵。 丙、鋼鐵-性質介於生鐵與熟鐵之間,彈性最大,用途最廣。 5. 含碳量:生鐵>鋼>熟鐵。 6. 不鏽鋼:鐵、鎳(Ni )、鉻(Cr )的合金(混合物)。 7. 磁卡、錄音帶上塗磁性的鐵氧化物。 |
|
鋁 |
1. 地殼中含量最多的金屬元素。 2. 質硬而輕,密度約為鐵的1 / 3 ,常用於製造飛機機身。
3.
活性比鐵大,但氧化物緻密,可保護內部,不再被氧化。 |
|
|
銅 |
1. 常溫下為紅色金屬,活性小, 2. 元素中導電與導熱第二名,常用於導線。 3. 青銅:銅、錫合金,是人類最早使用的合金,質軟熔點低,可製成銅像。 4. 黃銅:銅、鋅合金,可製成水龍頭、裝飾品。 |
|
|
銀 |
1. 導電與導熱最佳,常用於電子工業及製造錢幣、飾品。 2. 相片的感光材料為溴化銀(AgBr ) 。 3. 火山地區常有硫化氫氣體,與銀作用會產生黑色硫化銀(Ag2S)斑點。 |
|
|
金 |
1. 延展性最佳,可製成金箔。 2. 活性低,可製成抗腐蝕的導線。 |
|
|
汞 |
1. 俗稱水銀,為常溫常壓下唯一液態金屬(金屬中熔點最低者)。 2. 用於溫度計及氣壓計,日光燈管中也有汞蒸氣。 3. 有毒性,含汞物品需回收,如水銀電池。 |
|
|
鈦 |
1. 與大多數金屬皆可形成合金,質輕堅固,可製成高爾夫球桿頭、眼鏡等。 2. 人體對鈦不會有排斥作用,因而可用於人工關節、植牙材料。 3. 二氧化鈦粉末俗稱「鈦白粉」,可作為白色顏料,或添加於立可白中。 |
|
|
鎢 |
1. 熔點高,硬度大;常溫下為熔點最高的金屬。 2. 可製成燈泡的燈絲。 |
|
|
非金屬元素 |
碳 |
1. 可構成石墨、鑽石、芙(C60 )等同構異形體。 2. 石墨是唯一可導電的非金屬元素,俗稱「黑鉛」,可製成鉛筆芯。 3. 活性碳可過濾水或空氣中的雜質。 |
|
硫 |
1. 化石燃料中含硫元素,燃燒後生成具刺激性臭味的二氧化硫(SO2 ) ,溶於水形成酸性的亞硫酸(H2SO3 ),為酸雨的成份之一。 |
|
|
矽 |
1. 地殼中含量第二多的元素,或是地殼中含量最多的固態元素。 2. 為電子產業中IC 的重要原料。 |
(四)道耳吞原子說
|
道耳吞原子說 |
|
|||
|
1.
一切物質由原子組成,原子不可分割。
2.
相同元素的原子必相同,不同元素的原子必不相同。
3.
化合物是原子由固定比例組成。 4. 化學反應是原子重新排列組成新物質,過程中不會生成新原子,也不會有原子消失;可解釋質量守恆定律:化學反應前後所有物質的質量總和不變。 |
|
|||
|
物質的分類 |
||||
|
混合物 |
性質 |
1. 沒有一定的組成(可依任何比例混合); 2. 沒有一定的性質(熔點﹑沸點﹑密度不固定); 3. 可用物理方法分離出其他物質。 |
||
|
純物質 |
性質 |
1. 有一定組成; 2. 有一定性質(熔點﹑沸點﹑密度均一定); 3. 不可用物理方法分離;依組成元素的種類,分成元素和化合物兩大類。 |
||
|
元素 |
1. 不能以普通的物理方法再分解成其它的物質。 2. 依元素的物理性質及化學性質,可分成金屬元素及非金屬元素,其中非金屬元素較少,大部分是金屬元素。 3. 目前已知元素有108種,其中有88種存於自然界。 |
|||
|
化合物 |
1. 二種以上不同的元素相結合,所形成的純物質。 2. 化合物的性質和組成之成分元素的性質完全不同。 3. 一種元素只含有一種粒子,一種化合物中含有兩種以上的粒子。 4. 不能用物理方法分解為更簡單的物質,但能用適當的化學方法(如:電解﹑加熱)分解為更簡單的物質。 5. 化合物是由不同種類的原子相結合,元素是由相同種類的原子相結合。 |
|||
|
原子和分子 |
|
|||
|
原子 |
1. 組成物質的最小粒子,稱為原子。 2. 道耳吞認為原子不可再分割,實際上原子內部由電子、質子、中子組成。 3. 質子數和電子數決定原子的化學性質。 質子數相同,在週期表上為同一元素,質子數不同,即為不同元素。 |
|
||
|
分子 |
1. 具物質特性的最小粒子,如氫分子(H2)可燃,但H2O 中的H:指2 個氫原子而不是1 個氫分子(H2) ,所以H2O 不具可燃的特性。 2. 元素可以形成分子,如氧分子(O2),氯分子(C12);化合物也可形成分子,如氨分子(NH3),氯化氫分子(HCl)。 3. 單原子分子: 甲、氣體元素中只有惰性氣體,如氦(He)、氖(Ne)等,以「單原子分子」的形態存在。 4. 單原子分子活性小,性質安定,不易產生反應。 |
|
||
(五) 原子內部的結構
|
原子內部的結構 |
||
|
|
||
|
大小比較 |
1. 體積大小:晶體>分子>原子>原子核>質子=質子>電子。 2. 質量大小:中子>質子>電子。 3. 電量:電子帶一個負電(-1.6×10-19庫侖); 質子帶一個正電,中子不帶電。 |
|
|
發現順序 |
1. 電子最先(1897年,湯木生發現) è 研究陰極射線,政時代負電的電子。 2. 質子其次(1919年,拉塞福發現) è 以α射線撞擊氮原子,發現原子內部有帶正電的質子。 3. 中子最晚發現(1932年,查兌克發現) è 以α射線撞鈹原子,發線不帶電的中子。 4. 原子內部必定有質子,但不一定有中子,氫原子沒有中子。 |
|
|
原子序 |
1. 最早的週期表是蘇俄科學家門得列夫依照原子量排列。 2. 目前的週期表示莫色勒依照質子數目排列,所形成的週期表。 3. 質子數=原子序。 4. 中性原子的質子數=電子數,所以:質子數=原子序=原子序。 5. 陽離子(帶正電):質子數=原子序>電子數。 6. 陰離子(帶負電):質子數=原子序<電子數。 |
|
|
原子量 |
1. 原子所具有的質量,稱為原子量。 2. 原子量約等於質量數,因為電子質量太小,因此質量數=質子數+中子數。 |
|
|
同位素 |
||
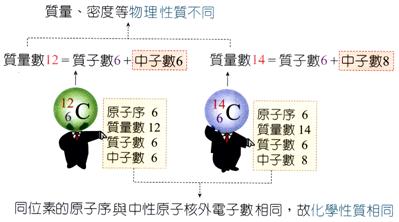 |
1. 原子內部具有相同的質子,但是中子數不相同,稱為同位素。 2. 同位素有不同的物理性質,但是有相同的化學性質。 3. 一般的化學反應涉及電子的交互作用,同位素有相同的電子數目,所以化學性質都相同。 |
|
(六)週期表的排列與性質:
|
|
|
|
週期表的分類 |
1. 同一行中各元素:金屬性及鹼性由上而下逐漸【增強】,非金屬性及酸性則反之。 2. 同一列中各元素:自左至右,酸性或非金屬性逐漸【增強】,鹼性或金屬性則反之。 3. 每一橫列表示一個【週期】,每一縱行表示一個【族】。 4. 同屬的元素具有相似的價電子組態,故化學性質【相似】。 5. 不同屬的元素有相同的價電子數,其化學性質也有類似之處。 |
|
鹼金族元素 |
1. 鹼金族元素包含【鋰、鈉、鉀、銣、銫、鍅】。 2. 質軟,能以刀片切割,密度小,比水【輕】,能浮於水面。 3. 活性大,在空氣中極易氧化,形成氧化物。 4. 需保存在礦物油 (如:【石油(煤油)】)中。 5. 能和水起激烈作用,並且放出【氫氣】。 6. 金屬為【銀白】色;離子為【無】色。 7. 鹼金族元素的化合物皆完全溶於水中。 |
|
鹼土金屬元素 |
1. 鹼土金屬元素包含【鈹、鎂、鈣、鍶、鋇、鐳】。 2. 鎂燃燒會產生【氧化鎂】,並且有強烈【白光】,可製閃光燈。 3. 鋁鎂合金堅硬質輕,可作為航空器材材料。 4. 鹼土族元素為【銀灰色】金屬,離子為【無色】。 5. 鹼土族元素遇到碳酸根(【CO32-】)或硫酸根(【SO42-】)會產生【白色】沉澱。 6. 水中含有鎂離子【Mg2+】、鈣離子【Ca2+】,稱為硬水,會將低肥皂的去污能力。 |
|
鹵素元素 |
1. 包含【氟、氯、溴、碘】。 2. 熔點【低】、沸點【低】,隨著原子量增加而【減少】。 3. 毒性隨著原子量增加而【減弱】。 4. 鹵素離子皆為【無】色。 5. 鹵素溶於水形成【酸性】溶液。 |
|
化學式的表示法 |
|
|
|
1.
金屬元素以一個原子代替。 2. 一般物質的化學式寫法:正價在前,負價在後。 3. 物質總價數為零。 4. 分子是只能判斷物質的種類和個數,無法判斷物質的性質。 5. 有機化合物一般用示性式表示,能呈現物質大約的性質。 |
【註】:1. H為氫原子,H2為氫分子;
2. 3H為3個氫原子,3H2為3個氫分子,共由6個氫原子組成。
留言者: 性別: 年齡: 星座: 地區: 心情:
連結: 密碼: